// Documenti disponibili n: 46.678
// Documenti scaricati n: 36.831.477
ID 13955 | 08.07.2021 / Documento allegato
Attualmente, tutte le imprese che ricoprono ruoli individuati dai Regolamenti per i quali sussiste l'obbligo di registrazione in Eudamed, possono procedere alla registrazione su base volontaria al fine di ottenere il Single Registration Number (SRN).
Tuttavia, la registrazione in Eudamed e l'ottenimento dell'SRN non sostituiscono l'obbligo di adempiere alla registrazione nella banca dati nazionale.
Nei prossimi mesi di uso del sistema su base volontaria, è prevista la doppia registrazione in Eudamed e nella banca dati Italiana. A tal proposito, si ricorda quanto previsto dal Regolamento (UE) 2017/745 nell’art.123.3(d) "Fino a quando Eudamed non sarà pienamente operativa (previsione Maggio 2022), le corrispondenti disposizioni delle direttive 90/385/CEE e 93/42/CEE continuano ad applicarsi al fine di ottemperare agli obblighi previsti”; per l’Italia tale circostanza è relativa agli obblighi di registrazione nella banca dati nazionale dei dispositivi medici del Ministero della Salute. Analoghe disposizioni sono previste per il settore IVD.
Nel corso di questa fase, il Ministero sta lavorando all’impostazione e gestione integrata dei sistemi di registrazione di livello nazionale ed europeo.
"Fino a quando Eudamed non sarà pienamente operativa, le corrispondenti disposizioni delle direttive 90/385/CEE e 93/42/CEE continuano ad applicarsi al fine di ottemperare agli obblighi previsti dalle disposizioni di cui al primo comma del presente punto per quanto riguarda lo scambio di informazioni tra cui, in particolare, quelle riguardanti rapporti di vigilanza, indagini cliniche, registrazione di dispositivi e operatori economici, e notifiche di certificazione".
Fig. 1 – Applicazione di Eudamed e Banca dati nazionale IT
1. La Commissione, in collaborazione con l'MDCG, elabora le specifiche funzionali di Eudamed. La Commissione elabora un piano per l'attuazione di tali specifiche entro il 26 maggio 2018. Il piano cerca di garantire la piena operatività di Eudamed in una data che consenta alla Commissione di pubblicare l'avviso di cui al paragrafo 3 del presente articolo entro il 25 marzo 2021 nonché il rispetto di tutti gli altri termini pertinenti stabiliti nell'articolo 123 del presente regolamento e nell'articolo 113 del regolamento (UE) 2017/746.
2. La Commissione, sulla base di una relazione di valutazione contabile indipendente, informa l'MDCG di aver verificato la piena funzionalità di Eudamed e la conformità di Eudamed alle specifiche funzionali elaborate a norma del paragrafo 1.
3. La Commissione, dopo aver consultato l'MDCG e aver appurato che le condizioni di cui al paragrafo 2 sono state soddisfatte, pubblica un avviso a tal fine nella Gazzetta ufficiale dell'Unione europea.
MIT, 03.09.2019
È attivo lo Sportello Telematico del Diportista (STED), che consente di poter effettuare le nuove immatricolazioni delle uni...
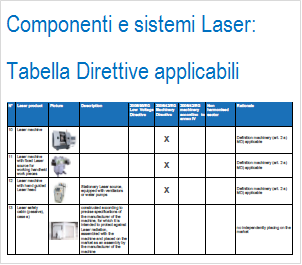
Il Documento presenta una tabella di corrispondenza di prodotti tipici laser e direttive applicabili e un allegato con spieg...

ID 9842 | Rev. 1.0 del 17.11.2025 / Documento di approfondimento e modello registro di controllo in allegato
Il Documento allegato il...
Testata editoriale iscritta al n. 22/2024 del registro periodici della cancelleria del Tribunale di Perugia in data 19.11.2024