// Documenti disponibili n: 46.563
// Documenti scaricati n: 36.582.453
1. Applying human factors and usability engineering to medical devices
2. List of highest priority devices for human factors review
Nel 2016 FDA ha pubblicato una nuova versione della linea guida sull’usabilità, “Applying human factors and usability engineering to medical devices”. Tale documento conferma l’attenzione dell’Agenzia per la sicurezza dei dispositivi medici, sicurezza che potrebbe essere compromessa da errori e pericoli durante l’utilizzo degli stessi.
La linea guida ha come oggetto principale i requisiti di usabilità che dovrebbe avere l’interfaccia utente dei dispositivi e include tutti i punti di interazione tra il prodotto e l’utilizzatore ossia display, controlli, packaging, etichette prodotto, istruzioni per l’uso ecc.
Per alcune categorie di dispositivi, identificate nella linea guida “List of highest priority devices for human factors review”, il CDRH raccomanda ai fabbricanti di dispositivi medici di includere nella relativa procedura di approvazione o notifica pre-market gli aspetti di usabilità legati al dispositivo e contenuti nella linea guida in oggetto.
FDA 2016
Collegati

EU, 07.06.2019
Nell’ambito dell’attività di valutazione di una possibile revisione della Direttiva Macchine, la Commissione Europea ha aperto una consultazion...
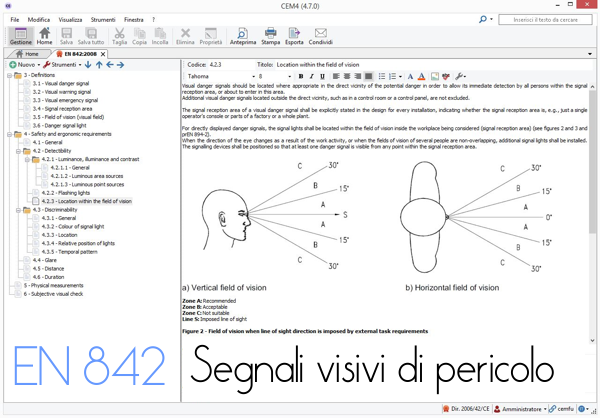
Testo Requisiti punti 3,4,5,6
La norma descrive i criteri per la percezione di segnali vis...

Circolare Min. Salute 0055528-P del 14.10.2016
Il Ministero mette a disposizione degli operatori sani...
Testata editoriale iscritta al n. 22/2024 del registro periodici della cancelleria del Tribunale di Perugia in data 19.11.2024