“Classificazione Nazionale Dispositivi medici” (CND) come base per la futura nomenclatura europea dei dispositivi medici (EMDN)
EU, Gennaio 2020
Lo scopo del documento "The CND Nomenclature - background and general principles" è quello di fornire informazioni riguardanti i principi di base e il struttura della “Classificazione Nazionale Dispositivi medici” (CND) italiana. Nel marzo 2019 e in base ai criteri stabiliti dal gruppo di coordinamento dei dispositivi medici (MDCG), il CND è stato selezionato come base per la futura nomenclatura europea dei dispositivi medici (EMDN) [vedi (MDCG 2018-2) – Future EU medical device nomenclature: Description of requirements].
Il EMDN supporterà il funzionamento di EUDAMED come dichiarato dal MDCG e in conformità con Articoli 23 del regolamento (UE) 2017/745 - MDR e regolamento (UE) 2017/746.
La nomenclatura europea dei dispositivi medici (EMDN) sarà la nomenclatura d'uso di produttori che registrano i loro dispositivi medici nel database EUDAMED.
Fondato su criteri e requisiti prestabiliti e basato sugli orientamenti forniti da il gruppo di coordinamento dei dispositivi medici (MDCG), ha deciso la Commissione europea favore dell'uso della "Classificazione Nazionale Dispositivi medici (CND)" come base per l'EMDN.
Attualmente è in corso una revisione straordinaria del CND in modo da rilasciare la prima versione dell'EMDN, che sarà integrato in EUDAMED per essere utilizzato dagli operatori. EMDN lo farà essere pienamente disponibile e accessibile a tutti gli operatori e sarà privo di copyright.
Nella misura del possibile, la Commissione mapperà l'EMDN sul dispositivo medico globale Nomenclatura (GMDN). Questo compito è stato intrapreso con la speranza di facilitare eventualmente Ricerca codice EMDN da parte degli operatori che attualmente utilizzano GMDN. La corrispondenza tra il le nomenclature sono destinate a essere visibili agli operatori e incorporate nel futuro database in la forma di uno strumento di ricerca. Pertanto, e in collaborazione con GMDN, la mappatura l'esercizio è attualmente in corso. Il livello di qualità e affidabilità di questa mappatura dipende sull'impegno di tutte le parti interessate a lavorare insieme per mappare e convalidare il risultati.
Un sottogruppo dell'MDCG sulla nomenclatura che comprende esperti nazionali
Sono state istituite autorità competenti e parti interessate per sovrintendere alle attività di regolamentazione collegato alla nomenclatura. Il sottogruppo mirerà a definire le regole e i processi relativi la creazione, l'aggiornamento, la manutenzione e l'uso della nomenclatura europea dei dispositivi medici.
Inoltre, la Commissione sta attualmente collaborando con l'Organizzazione mondiale della sanità (OMS) nel contesto del loro lavoro e delle loro attività su un futuro dispositivo medico internazionale nomenclatura.
Attualmente è in corso una revisione straordinaria del CND in modo da rilasciare la prima versione dell'EMDN, che sarà integrato in EUDAMED per essere utilizzato dagli operatori. EMDN lo farà essere pienamente disponibile e accessibile a tutti gli operatori e sarà privo di copyright.
Nella misura del possibile, la Commissione mapperà l'EMDN sul dispositivo medico globale Nomenclatura (GMDN). Questo compito è stato intrapreso con la speranza di facilitare eventualmente Ricerca codice EMDN da parte degli operatori che attualmente utilizzano GMDN. La corrispondenza tra il le nomenclature sono destinate a essere visibili agli operatori e incorporate nel futuro database in la forma di uno strumento di ricerca. Pertanto, e in collaborazione con GMDN, la mappatura l'esercizio è attualmente in corso. Il livello di qualità e affidabilità di questa mappatura dipende sull'impegno di tutte le parti interessate a lavorare insieme per mappare e convalidare i risultati.
...
The CND Nomenclature - background and general principles
Background and General Principles
In 2005, the Italian Ministry of Health set out that the CND would be the official Italian medical device classification and nomenclature. Since then, the CND has been implemented not only in Italy, but also in Portugal and Greece.
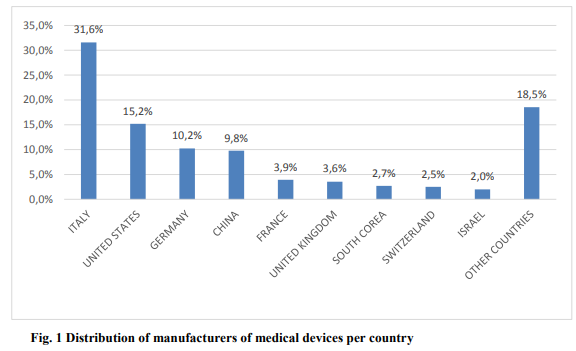
About 15.000 manufacturers from various countries have used the CND for the registration of medical devices and in vitro diagnostic medical devices in the Italian database. The distribution of manufacturers of medical devices and in vitro diagnostic medical devices per country is reported below in Figure 1.
The CND nomenclature is one of the tools used in the governance of the medical device sector and is characterised by its refined and hierarchical structure. It aims to support the improvement of patient safety and the quality of health systems by enabling information to be communicated in a standardised manner.
Updates and maintenance of CND:
The construction of the CND, its subsequent updates and maintenance have been based on three fundamental principles.
A) Participative approach:
For the update and maintenance of a qualitative nomenclature, highly differentiated and qualified expertise is required. As the medical device sector is acknowledged for its heterogeneity and complexity, a broad participation of all stakeholders (economic operators and healthcare professional from NHS - at all levels of its organisation) is essential.
B) Qualified validation of proposals:
Nomenclature and Classification proposals are technically validated based on assessments of actual need. Factors taken into consideration are:
- other existing nomenclature and classification systems available at international level
- consumption and expense information
- assessment with sector experts from the different disciplines
C) Formal adoption and free public availability:
The CND system, which represents the basis of the whole information system on medical devices is formally approved and thus constitutes an official reference, freely available to all stakeholders.
More information on previous updates of the CND up to 2018 can be found in Annex I of this document.
The following products are currently not included in the CND:
- Medicinal products
- Cosmetics products
- Human blood and its derivatives;
- Organs, tissues and cells of human origin, products including human tissues and cells and products derived therefrom.
- Organs, tissues and cells of animal origin except medical devices manufactured using animal devitalized tissues or devitalized products derived from animal tissue.
- Individual Protection Devices
The CND structure
The CND is characterised by its alphanumeric structure that is established in a multi-level hierarchical tree. It clusters medical devices in three main levels:
- Category: the first hierarchical level
- Group: the second hierarchical level
- Type: the third hierarchical level (which if necessary, expands into several levels of detail (1°, 2°, 3°, 4° e 5°)

Each medical device is classified by an alphanumeric code consisting of a letter referring to the “Category”, a couple of numbers referring to the “Group” and a series of other couples of numbers referring to the “Type” (whose amount depends on the level of detail) up to a maximum of 7 levels.
Each level is identified by:
...segue in allegato
_______
Collegati:
Allegati
|
Descrizione |
Lingua |
Dimensioni |
Downloads |
 |
|
EN |
340 kB |
17 |
 |
|
EN |
1017 kB |
13 |